Détermination de la concentration par la mesure de la masse volumique
S'il existe une relation entre la concentration d'une substance dans une solution et la densité de la solution, la concentration peut être déterminée en mesurant la densité de la solution. Cet article se concentre sur les solutions binaires, les différentes possibilités de mesurer leur concentration, et met en évidence les unités les plus importantes pour la description de ces mélanges.
Aspects généraux
La densité des liquides change si les ingrédients changent. Par exemple : une boisson gazeuse contenant du sucre aura une densité plus élevée qu'une boisson gazeuse diététique. Donc, le sucre n'augmente pas seulement la densité d'un liquide, il peut également être mesuré inversement en connaissant la densité du liquide dans un type de liquide donné. Utiliser cette corrélation fournit des informations utiles dans la production de nombreuses boissons.
Figure 2 : Le mélange de deux échantillons avec des densités connues A et B donne un mélange avec une densité qui se situe entre la valeur A et B.
Mélanges binaires et quasi-binaires
Les mélanges à deux composants sont appelés mélanges binaires. La masse volumique du mélange est fonction de sa composition. Ainsi, à l'aide des tableaux de concentration, il est possible de calculer la composition d'un mélange binaire à partir de la valeur de sa masse volumique. Des mélanges typiques à deux composants sont par exemple des solutions alcool-eau, des solutions sucre-eau, des solutions sel-eau, et des acides ou des bases dissous dans l'eau. La mesure de concentration est possible également avec les mélanges dits quasi binaires. Ces mélanges contiennent deux composants principaux et quelques ingrédients additionnels, dont la concentration est très faible par rapport à celle des deux composants principaux. Certains ingrédients supplémentaires sont présents dans de petites concentrations mais, en raison du faible impact sur la densité, peuvent être ignorés. La détermination de la concentration est également possible lorsqu'un mélange contient plusieurs composants, mais qu'un seul d'entre eux varie tandis que tous les autres ingrédients restent constants.

Mesure de la densité à l'aide d'un densimètre numérique
D’innombrables méthodes d’analyses prévalent actuellement dans le contrôle qualité et la production Cependant, il ne sont pas tous aussi faciles, rapides et significatifs qu'un densimètre numérique. Les densimètres modernes nécessitent très peu d'échantillon, ne changent pas la composition de l'échantillon, ne dépendent pas de l'opérateur, réduisent la consommation de produits chimiques et fonctionnent avec une précision maximale.
L'échantillon est injecté dans un tube en U qui est mis en oscillation à sa fréquence caractéristique par voie électronique. La fréquence caractéristique varie en fonction de la masse volumique de l'échantillon injecté. La masse volumique de l’échantillon peut être calculée en déterminant précisément la fréquence caractéristique. En raison de la forte dépendance entre la température et la masse volumique, la température de la cellule de mesure doit être contrôlée avec précision. Les densimètres modernes à haute précision fournissent en outre une correction de viscosité et un oscillateur de référence pour permettre des résultats précis sur une large gamme de densités, de températures et de viscosités. La méthode du tube en U oscillant est utilisée pour mesurer la masse volumique réelle ρ des fluides.
Figure 5 : Principe du tube en U oscillant (tube en U rempli d'air ou d'eau)
Conversion de la densité en unités de concentration
La densité d'un mélange peut être convertie en une unité de concentration en utilisant un tableau de concentration approprié ou, plus généralement, une formule de conversion. Presque toutes les solutions binaires peuvent être caractérisées en utilisant des fonctions liées à la densité et des tableaux de concentration. Ces tableaux peuvent provenir soit de la littérature, soit de données expérimentales individuelles. La concentration des solutions ou mélanges est souvent exprimée en termes de pourcentage de composition de la solution sur une base de poids ou de volume.
| Quantité |
Unité Tables d'éthanol |
AOAC 60 °F, HM C&E, IUPAC, KAEMPF, OIML, OIML-ITS-90, Proof 60 °F, Tableau d'alcool d'accise canadien, OIML-Shusei-Do |
%v/v (Vol.-%), %w/w (%m/m, Gew.-%), °Proof Tables d'extrait/sucre |
Baumé, Concentration de sucre, Concentration de masse de sucre |
°Baumé, °Brix, °Plato, g/L, kg/m³ Tables d'acide/base |
HCl, HNO3, H3PO4, NaOH, H2SO4 |
%w/w (%m/m, Gew.-%), mol/L, N Fonctions API |
Gravité API 15 °C / 20 °C / 29.5 °C / 60 °F, Densité API 15 °C / 20 °C / 29.5 °C / 60 °F, Quantité d'entrée API, Groupe de produits API, Gravité spécifique API 15 °C / 20 °C / 29.5 °C / 60 °F | g/cm³, kg/m³, lb/gal, g/mL |
Dans le domaine chimique, les concentrations sont souvent exprimées en %poids/poids ou %masse/masse. Ceci est abrégé en %w/w ou %m/m. En général, cela signifie : gramme du composant par 100 grammes de la solution. Un exemple : 5 % d'acide sulfurique signifie qu'il y a 5 grammes d'acide sulfurique dans 100 grammes de la solution. La température peut être ignorée ici, car la température n'a aucune influence sur le poids ou la masse. Alors que la plupart des industries utilisent %poids/poids, l'industrie de l'alcool rapporte principalement leur concentration en %volume/volume. Si vous regardez une bouteille de bière, vous verrez généralement la teneur en alcool indiquée en %V/V. Cela, bien sûr, est une unité dépendante de la température. Dans l'industrie pharmaceutique, par exemple, une solution de désinfection peut contenir 70 % d'éthanol (V/V). Cela signifie qu'il y a 700 mL d'éthanol dans 1 L de solution. Une unité de concentration courante dans l'industrie de la brasserie pour décrire la concentration de la bière et du moût est °Plato ou °Balling. Cela fait référence au contenu extrait dans le produit, typiquement le moût de bière, et est plus ou moins le même.
°Le proof est une autre unité utilisée principalement dans l'industrie des spiritueux aux États-Unis. C'est %V/V d'alcool multiplié par 2 à 60 °F[1]:
$$°Proof ^{60°F} = 2 * P^{60°F}$$
L'API, qui signifie American Petroleum Institute, a proposé son propre terme de gravité ° API Gravity[2] pour caractériser facilement les produits pétroliers lourds ou légers par rapport à l'eau : Si la gravité API (à 60 °F) d'un produit pétrolier est supérieure à 10, il est "léger" et flotte sur l'eau, s'il est inférieur à 10, il est "plus lourd" que l'eau et coule. La gravité API est rapportée en degrés et calculée sur la base d'une formule, qui inclut la gravité spécifique. Selon le pays ou la norme, 60 °F ou 15 °C sont utilisés comme température associée. Cette échelle est généralement utilisée pour la plupart des transactions aux États-Unis ainsi que dans la pratique des raffineries à travers le monde.
$$ Gravité API = {141,5 \over SG} - 131,5 $$
Équation 1 : Formule pour calculer la gravité API d'un produit pétrolier en fonction de la gravité spécifique SG d'un échantillon
Dans l'industrie chimique, °Baumé peut être utilisé comme unité. C'est similaire au numéro d'API, utilisant la gravité spécifique SG dans une formule.
$$ °Bé = {140 \over SG } - 130 \hspace{10mm} SG\leq1$$ $$ °Bé = 145 - {145 \over SG } \hspace{10mm} SG>1$$
Dans l'industrie des boissons gazeuses, °Brix[5] est utilisé pour le degré de saccharose ou le degré d'extrait dans le produit. °Brix et °Plato sont essentiellement identiques.
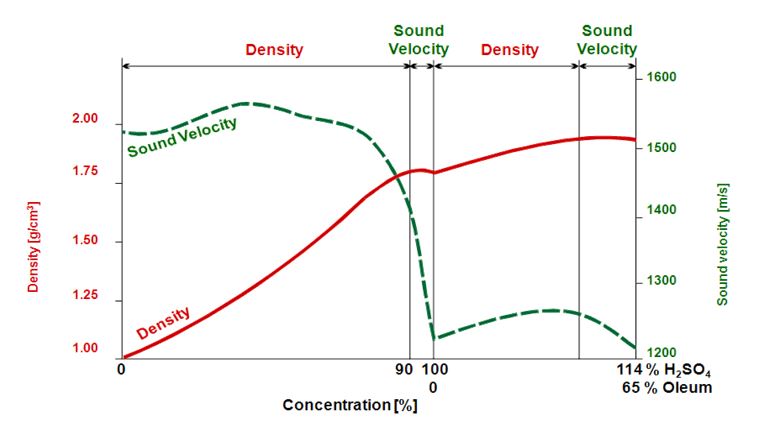
Une relation non-linéaire : Détermination de la concentration de l'acide sulfurique
Parfois, un tableau de concentration pour une substance spécifique ne couvre pas toute la plage de concentration de 0 %w/w à 100 %m/m Une raison pourrait être que le soluté est déjà présent en une quantité à laquelle aucun autre ne peut être dissous («saturation»). Une autre raison pourrait être que la densité de la solution ne montre pas de relation linéaire avec la valeur de concentration. C'est le cas de l'acide sulfurique : Lors de la détermination de l'acide sulfurique dans l'eau, la mesure de la densité donne des lectures de concentration précises dans une plage de concentration de 0 % à 87 %. Mais si la concentration d'acide sulfurique est plus élevée (87 % à 100 %), la densité n'augmente plus avec des quantités croissantes d'acide dissous.
Une autre raison pourrait être que la densité de la solution ne montre pas de relation linéaire avec la valeur de concentration. La valeur de densité montre un maximum à une concentration d'acide sulfurique de 87 %, ce qui entraîne une valeur qui ne peut plus être corrélée à une seule concentration. Pour couvrir toute la plage de concentration, un deuxième paramètre de mesure doit être utilisé, par exemple la vitesse du son (Figure 5).
Précision du résultat de la mesure
L'exactitude du résultat de mesure dépend non seulement de l'exactitude de la densité de l'instrument de mesure, mais aussi de la qualité des données de référence (c'est-à-dire le tableau de densité à concentration) et du calcul derrière la fonction de conversion (par exemple, un tableau ou une fonction polynomiale). Plus votre mesure de densité est précise, plus votre détermination de concentration le sera. Exemple : Comment calculer la précision
Une solution de chlorure de sodium (NaCl) est mesurée avec un instrument ayant une précision de 0,000005 g/cm³. Deux concentrations de la solution (0,5 %p/p et 1,5 %p/p NaCl) sont considérées car elles couvrent la plage de concentration d'échantillon attendue. Les densités des deux solutions sont mesurées et la différence ∆ entre les densités est calculée.
| NaCl | |||
| 0,5% m/m | ...... | 1,0018 g/cm³ | |
| 1,5 % m/m | ....... | 1,0089 g/ml | |
| Δ | ....... | 0,0071 g/cm³ |
La différence ∆ de 1,0 %m/m correspond à un changement de densité de 0,0071 g/cm³, ainsi la précision de la solution de NaCl est : (1,0 x 0,000005)/0,00710 = 0,007 %m/m Ceci est la précision moyenne pour l'ensemble de la plage comme défini ci-dessus, et n'est vrai que si la relation entre la densité et la concentration est linéaire. Vous pouvez obtenir des résultats plus précis avec votre tableau d'utilisateurs lorsqu'il y a de nombreuses paires de données obtenues (valeur de densité et concentration correspondante) avec une grande précision. En raison du comportement non linéaire des solutions réelles, la précision n'est valable que dans une certaine plage de concentration.
Méthodes alternatives pour déterminer la concentration
Titration: Un inconvénient courant de la titration est qu'elle nécessite un opérateur qualifié avec des connaissances en chimie. Une plage de concentration limitée est couverte, donc l'échantillon doit être dilué en conséquence. De plus, une configuration spéciale en fonction de chaque échantillon individuel est nécessaire. Un autre inconvénient de la titration est l'utilisation de produits chimiques agressifs et le besoin de consommables coûteux. Ces points rendent cette méthode très chronophage et peu conviviale.
Pycnomètre : Un pycnomètre est un dispositif de mesure abordable qui fournit des résultats de mesure très précis. Cependant, pour obtenir des résultats très précis, un opérateur très qualifié est nécessaire ainsi qu'une balance très précise. Un autre inconvénient est le contrôle de la température de l'échantillon dont une grande quantité (jusqu'à 100 mL) est nécessaire. Dans l'ensemble, cette méthode est assez fastidieuse et il n'est possible de déterminer que la densité apparente de l'échantillon, donc la flottabilité de l'air doit être compensée.
Hydromètre : Les hydromètres sont abordables et fournissent une mesure de concentration très rapide. Cependant, l'échelle peut facilement être mal interprétée et une correction de température est nécessaire. Comme c'est le cas avec les pycnomètres, une grande quantité d'échantillon est nécessaire et l'hydromètre peut se casser facilement.
Balance hydrostatique : Les balances hydrostatiques sont utilisées dans des installations spéciales, par exemple le Bureau national des normes, car elles sont incroyablement précises et fiables. Cependant, une balance hydrostatique est un énorme appareil complexe avec une fondation en béton qui doit être isolée et contrôlée en température de manière extensive. Cet "instrument" est très cher et n'est pas adapté à l'industrie. Les mesures prennent énormément de temps et peuvent prendre un à deux jours.
Conclusion
Déterminer la concentration des mélanges binaires est nécessaire chaque fois qu'un produit liquide est produit, échangé ou consommé. Les bases des mélanges binaires sont présentées dans cet article, ainsi que les méthodes de mesure et les différentes unités pour comparer et caractériser les produits en fonction de l'industrie.