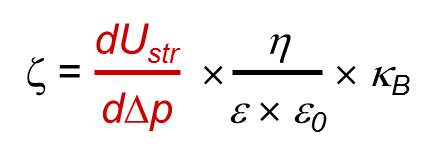Potentiel zêta
Ces dernières années, les mesures du potentiel zêta sont devenues une importante méthode de caractérisation pour la fonctionnalité de surface ou la stabilité des particules dispersées. Le point central de l’analyse du potentiel zêta est d’obtenir des informations sur la charge de surface d’une matière. Le matériau peut varier des nanoparticules colloïdales jusqu'aux surfaces macroscopiques comme les membranes ou les plaquettes de silicium. Cet article décrit la théorie derrière le potentiel zêta, explique pourquoi il dépend de la valeur du pH et de la force ionique du milieu, et décrit les techniques utilisées pour l'analyse du potentiel zêta.
Qu’est-ce que le potentiel zêta ?
Le potentiel zêta (également connu sous le nom de potentiel électrocinétique) est établi à la surface de tout matériau lorsqu'il entre en contact avec un milieu liquide. C'est donc une propriété interfaciale. Il est généralement donné en unité de millivolts. Lorsqu'un matériau solide entre en contact avec un liquide, les groupes fonctionnels présents à sa surface subissent des réactions avec le milieu environnant. Ce processus entraîne une charge de surface, qui attire l'accumulation d'ions de charge opposée. Ces ions de contrepartie s'organisent spontanément dans une soi-disant couche double électrochimique. Le potentiel zêta est défini comme la somme de la charge de surface initiale et de la couche accumulée. Les éléments suivants doivent être gardés à l'esprit lors de la discussion sur le potentiel zêta :
- Le potentiel zêta n'est présent que si un matériau entre en contact avec un liquide. Il représente la charge nette effective dans cette condition.
- Le potentiel zêta peut être mesuré sur des surfaces macroscopiques (par exemple, membranes, cheveux, polymères) ainsi que sur des particules dispersées dans un liquide (par exemple, colloïdes, nanoparticules, liposomes). Les deux types sont considérés comme "matériel". Cependant, la différenciation est importante afin de choisir la bonne technologie pour mesurer le potentiel zêta.
- Les propriétés du milieu liquide jouent un rôle important dans la formation du potentiel zêta, qui dépend fortement de la valeur du pH ou de la concentration du tampon.
- Une charge de surface peut être observée pour les matériaux solides (interface solide-liquide) ainsi que pour les gouttelettes liquides (interface liquide-liquide).
Pourquoi le potentiel zêta est important
Mesurer le potentiel zêta fournit des informations sur la fonctionnalité de surface, la stabilité des particules dispersées ainsi que l'interaction des composés dissous avec la surface solide. Le potentiel zêta des surfaces macroscopiques est donc important pour comprendre le comportement des matériaux solides dans de nombreux processus techniques dans lesquels les systèmes aqueux jouent un rôle, par exemple, les membranes pour le traitement de l'eau, les biomatériaux en contact avec le sang, ou le traitement humide des plaquettes de semi-conducteurs. La connaissance du potentiel zêta d'un matériau vous aide à optimiser des processus de modification de surface spécifiques pour qu'un matériau fonctionne au mieux lorsqu'il est appliqué. Le potentiel zêta des particules est un indicateur clé de la stabilité d'une dispersion colloïdale, comme les nanoparticules ou les liposomes, car il reflète la capacité des particules à se repousser électrostatiquement. Empiriquement, on considère que des valeurs absolues de potentiel zêta supérieures à ± 30 mV sont indicatives de dispersions stables. Seule l'amplitude du potentiel zêta indique la stabilité de l'échantillon, tandis que le signe du potentiel zêta montre si les charges positives ou négatives sont dominantes à la surface. En dessous de ± 30 mV, des processus comme l'agrégation, la sédimentation et/ou la floculation sont plus susceptibles de se produire.
La double couche électrochimique
Formation de charge de surface
Lorsqu'une surface solide entre en contact avec un milieu aqueux, une formation de charge se produit et entraîne un potentiel de surface Ψ0. La formation de charge se produit en raison de
- réactions des groupes fonctionnels ou
- adsorption d'ions de la solution.
La formation de charge par réaction de groupes fonctionnels est basée sur des groupes de surface acides et basiques. Les groupes acides tels que l’acide carboxylique ou sulfonique se dissocient lorsqu’ils sont en contact avec l’eau, c’est-à-dire que l’ion H+ est libéré dans l’eau environnante et la surface prend une charge négative. Les groupes basiques tels que les groupes amines deviennent protonés au contact de l’eau, c’est-à-dire que la surface prend une charge positive (Figure 1). L'équilibre de dissociation et de protonation dépend fortement de la valeur du pH du milieu liquide et a donc une forte influence sur la charge de surface formée du matériau et par conséquent sur le potentiel zêta.
Cependant, la présence de groupes fonctionnels n'est pas un prérequis pour la formation de charges. Sur des surfaces inertes, une charge de surface négative se forme en raison de l'adsorption préférentielle des ions hydroxyde de l'eau. Les surfaces inertes sont donc chargées négativement à pH neutre et alcalin. C'est seulement à un pH bas, où la concentration des ions hydronium devient dominante, que les surfaces inertes présentent une charge de surface positive. Encore une fois, la formation de charge par adsorption dépend fortement de la valeur du pH (Figure 2).
Couche immobile et diffuse
La charge de surface expliquée ci-dessus entraîne un potentiel de surface Ψ0 et a un effet sur l'agencement des anions et des cations du milieu aqueux. Le comportement de charge à l'interface solide-liquide et la définition du potentiel zêta sont bien expliqués en utilisant le modèle de la double couche électrochimique (EDL), qui se compose d'une couche stationnaire et d'une couche diffuse (Figure 3).
- Une couche stationnaire se forme directement à la surface. Les ions dans cette couche sont immobilisés en raison des fortes interactions avec la surface.
- La couche externe est appelée la couche diffuse car les ions sont moins attirés par la surface et ont la capacité de se déplacer à l'intérieur de cette couche.
La frontière entre la couche immobilisée et la couche diffuse est caractérisée comme le plan de cisaillement et spécifie quelle partie de la double couche électrochimique contribue à la charge nette globale du matériau. Par conséquent, le potentiel qui est présent au plan de cisaillement est défini comme le potentiel zêta.
mesure du potentiel zêta
Les effets électrocinétiques comme le potentiel zêta peuvent être déterminés avec quatre techniques de mesure différentes :
- Potentiel d'écoulement
- Électrophorèse
- Électroosmose
- Potentiel de sédimentation
Le potentiel de streaming et l'électrophorèse sont les deux techniques les plus courantes et sont mises en œuvre dans des instruments comme le SurPASS (potentiel de streaming) et Litesizer (électrophorèse). Le potentiel de streaming est généralement utilisé pour la détermination du potentiel zêta de surfaces plus grandes (diamètre >25 µm) et des méthodes électrophorétiques comme la diffusion de la lumière électrophorétique sont appliquées pour mesurer le potentiel zêta de particules d'un diamètre allant jusqu'à 100 µm.
Potentiel d'écoulement
Les mesures du potentiel d'écoulement sont appliquées aux surfaces macroscopiques, où les échantillons sont montés sur des porte-échantillons et forment un canal d'écoulement capillaire (Figure 4). Lors du mouvement relatif du liquide par rapport à l'échantillon solide, les ions de la double couche électrochimique sont arrachés de leur position d'équilibre et déplacés le long de la surface solide. La séparation de charge résultante donne lieu à des effets électrocinétiques, l'un d'eux est appelé potentiel de streaming. Le potentiel de streaming, ou alternativement les données de courant de streaming, sont utilisés pour calculer le potentiel zêta. Les équations fondamentales qui relient le potentiel d'écoulement et le courant d'écoulement au potentiel zêta ont été dérivées par Hermann von Helmholtz et Marjan von Smoluchowski. L'équation utilisée pour le calcul du potentiel zêta à l'aide des données de courant de streaming nécessite une connaissance exacte de la longueur et de la section transversale du canal de streaming, c'est-à-dire la taille de l'échantillon solide.
Équation 1: dl/dp: pente du courant de streaming par rapport à la pression différentielle
η: viscosité de l'électrolyte
ε: coefficient diélectrique de l'électrolyte
ε0: permittivité
L: longueur du canal de streaming
A: section transversale du canal de streaming L'équation est donc bien adaptée pour les investigations du potentiel zêta des solides plans, mais n'est pas adaptée pour l'évaluation du potentiel zêta d'échantillons de forme irrégulière. Pour les types d'échantillons où la géométrie du canal d'écoulement est inconnue (par exemple, des solides plans de taille irrégulière, des fibres, des textiles et des échantillons granulaires), une dérivée de l'équation de Helmholtz-Smoluchowski est applicable. Cette équation utilise des données de potentiel de streaming en combinaison avec la conductivité de l'électrolyte.
Diffusion électrophorétique de la lumière (ELS)
Le potentiel zêta des particules est généralement mesuré par la diffusion de la lumière électrophorétique (ELS). Contrairement aux mesures de potentiel de streaming, aucun mouvement du liquide n'est généré, mais le mouvement des particules est induit. Par conséquent, un champ électrique est appliqué et la mobilité électrophorétique des particules est utilisée pour calculer le potentiel zêta. En raison du champ électrique, les particules se déplaceront à des vitesses différentes : les particules fortement chargées se déplaceront plus vite que les particules moins chargées. La mobilité électrophorétique (vitesse des particules dans un champ électrique) est déterminée par l'analyse de la lumière par diffusion de phase (PALS). Le mouvement des particules dans le champ électrique appliqué entraîne un décalage de fréquence d'un faisceau laser incident, également connu sous le nom de décalage Doppler. Les décalages de fréquence enregistrés sont proportionnels à la vitesse des particules et peuvent être utilisés pour mesurer la mobilité électrophorétique et le potentiel zêta. Cependant, les décalages de fréquence réels observés dans ELS sont trop petits pour être mesurés directement. De plus, ils ne fournissent des informations que sur la valeur absolue du potentiel zêta, mais pas sur le signe (si la valeur est positive ou négative). Ces limitations sont résolues en utilisant un faisceau de référence, qui est ensuite combiné avec le signal de mesure à nouveau au détecteur de diffusion (Figure 5). Le faisceau de référence est décalé Doppler par un modulateur, ce qui entraîne un décalage de fréquence, qui doit être connu pour le calcul du résultat de la mesure. La technique brevetée cmPALS (analyse de la lumière par diffusion de phase surveillée en continu) utilise un détecteur supplémentaire pour le suivi en direct du décalage Doppler du faisceau de référence modulé (détecteur de surveillance dans la Figure 5) au lieu d'un calcul théorique. Cela entraîne des mesures plus rapides, une meilleure reproductibilité même à faibles champs électriques appliqués ainsi qu'une sensibilité accrue de la mesure.
Les mesures ELS sont utilisées pour l'analyse des particules et la méthode est souvent combinée avec la diffusion dynamique de la lumière, qui est utilisée pour la détermination de la taille des particules basée sur le mouvement des particules dû au mouvement brownien.
Potentiel zêta et ses dépendances
Le potentiel zêta dépend à la fois de la surface de l'échantillon lui-même mais aussi des propriétés de la phase liquide. La dépendance du potentiel zêta au pH est l'une des dépendances du potentiel zêta les plus largement étudiées (expliquée ci-dessus). Les mesures à différents pH fournissent des informations précieuses sur la composition de la surface de l'échantillon, c'est-à-dire la présence de groupes fonctionnels acides ou basiques. Les systèmes automatisés pour les mesures dépendantes du pH empêchent ainsi des ajustements manuels répétés et prolongés de la valeur du pH. La valeur de pH à laquelle le potentiel zêta est de 0 mV est connue sous le nom de point isoélectrique et est utilisée comme indicateur de la chimie d'une surface et est donc utilisée pour la caractérisation des protéines et des peptides ainsi que pour le développement de nouvelles formulations pharmaceutiques.
En plus de la valeur du pH, la concentration d'ions dans la phase aqueuse (par exemple, à travers différentes concentrations de tampon) a également une influence sur le potentiel zêta. Si plus d'ions sont disponibles, la charge de surface initiale peut être compensée beaucoup plus rapidement, ce qui entraîne un potentiel zêta mineur. Cela signifie qu'en augmentant la concentration du tampon, le potentiel zêta diminue. Cet effet peut être observé par exemple par dilution avec de l'eau pure au lieu du solvant initial.
Potentiel zêta pour les études d'adsorption
Le potentiel zêta est très sensible à la surface solide la plus externe. Il est donc parfaitement adapté pour surveiller les changements de la charge de surface lors de l'adsorption de substances dissoutes en solution sur la surface solide. La dépendance en fonction du temps et de la concentration des processus d’adsorption est directement accessible en surveillant le changement respectif dans les données sur le potentiel de flux, le courant de flux ou le potentiel zêta. La connaissance de la charge de surface et de ses variations dues à l'adsorption liquide-sur-solide est importante pour ajuster les propriétés des matériaux et optimiser les processus. Il est possible d'étudier les modifications des propriétés de surface dues à la modification, le stockage, le vieillissement ou l'usure lors du fonctionnement.
Conclusion
La mesure du potentiel zêta est une méthode de caractérisation courante pour les surfaces macroscopiques ainsi que pour les systèmes particulaires. Parmi plusieurs techniques, les mesures de potentiel de streaming et électrophorétiques comme la technique cmPALS du Litesizer 500 sont les plus courantes. En savoir plus sur l'analyse du potentiel zêta sur les surfaces solides avec l'Anton Paar SurPASS 3
En savoir plus sur cmPALS et la série Litesizer pour une analyse complète des particules
En savoir plus sur les systèmes de mesure de charge de surface et de potentiel zêta chez Anton Paar
Littérature supplémentaire
Anton Paar. (n.d.) Faster, More Sensitive Zeta-Potential Measurements with cmPALS and the Litesizer™ 500. [24 janvier 2019].
Bellmann, C., Caspari, A., Moitzi, C., Fradler, C., Babick, F. (2018) Guide DLS & ELS.
Luxbacher, T. (2014) The Zeta Guide.